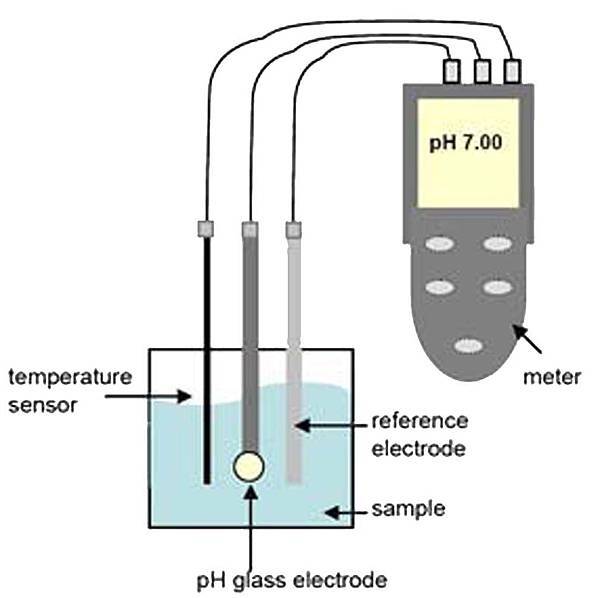
一、儀器說明
pH meter在實驗室是一種十分普遍的儀器,其使用頻率高且常用於量測各式各樣的基質樣品,如廢水、飲用水、海水及製程上的樣品等,如果使用不當,則可能導致錯誤的結果。標準pH量測設備通常包含(1)pH電極、(2)溫度補償探棒、(3)pH meter(主機)。
二、pH之定義
pH值一般定義為溶液中氫離子活性(α)的負對數值。
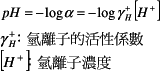
在純水及稀薄溶液中,氫離子活性可視為與氫離子濃度相同,故
![]()
純水在25℃,其離子積常數(ion product of water)
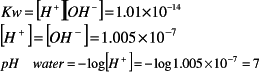
圖一為酸鹼pH值相對之電位值。
圖 一
三、原 理
pH量測牽涉溶液未知〔H+〕電位與已知參考電位之比較。
pH meter將參考半電池(reference half–cells)與偵測半電池(sensing half–cells)轉換成pH值。現今,大部分的電極係將參考和偵測半電池做在一起,成複合式電極。
當pH電極浸入樣品溶液中,其感應玻璃膜(sensing glass membrane)將會產生一電位。如果未知溶液是中性,其總固定電位差在玻璃膜(glass membrane)內表面和偵測導體(sensing conductor)約莫等於玻璃膜(glass membrane)外表面和參考半電池,其結果使總電位差為0mV,此時pH值為7。
在酸鹼溶液,其外部薄膜表面(outer membrane surface)電位的改變正比於〔H+〕濃度,pH meter測定其電位與未知〔H+〕濃度的改變可用Nernst equation來表示:

四、校正與量測
使用pH meter前,必須加以校正。一般先用pH 7的緩衝溶液校正,再用pH 4或10的緩衝溶液(視水樣之pH值而定),最後再用第三種緩衝溶液當做QC樣品,來查核校正線。緩衝溶液的pH值會受溫度影響,其影響程度對pH 10的緩衝溶液較pH 4的緩衝溶液明顯。是故緩衝溶液的溫度必須知道,以便進行溫度因子修正。校正與操作步驟會因不同的儀器而有所不同,請參照儀器手冊。圖二為pH值相對應電位直線圖,以25℃緩衝溶液校正直線其斜率為 59.16mV/pH。
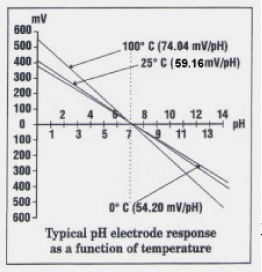
圖 二
水樣的pH可能會在採樣後數小時甚至幾分鐘後會因為排氣(degassing)如二氧化碳、硫化氫及氨的溢散、礦物沈澱(如形成碳酸鈣),溫度改變、其他物理化學及生物反應而改變。
現場環境包括下雨、風、粉塵及太陽光都可能影響分析的結果,如可能的話儘量不要使儀器在操作過程曝露於惡劣的環境下。在乾燥、多風的天氣,pH計表面容易形成靜電,而導致錯誤的結果。
儀器校正過後,即可直接測量水樣,將pH電極與溫度探棒放入於樣品適當深度,至少停留60秒使其平衡。
如果pH meter系統包含自動溫度補償(automatic temperature compensator, ATC),使用ATC測量水溫。如果儀器系統不含自動溫度補償,使用一分離式已被校正過之溫度計,調整主機(meter)至同樣品溫度(如必要)。測值通常可很快地穩定在±0.05至0.1pH。記錄所觀察結果之中間值。如果讀值無法穩定,則記錄此結果於現場記錄表,並記錄最後五次讀值之中間值。


 留言列表
留言列表 國外廠商
國外廠商 